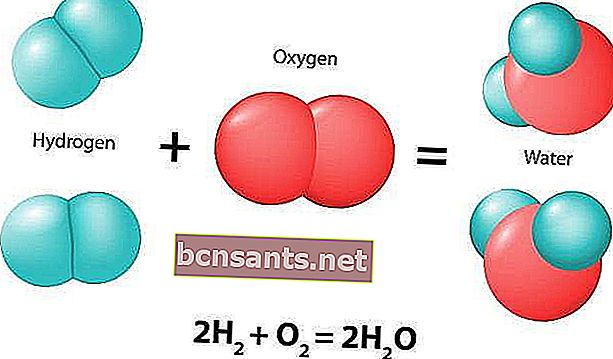
Kimyasal reaksiyon, kimyasal bileşiklerde her zaman değişiklikler üreten doğal bir süreçtir . Reaksiyona dahil olan ilk bileşik veya bileşiklere reaktanlar denir.
Kimyasal reaksiyonlar genellikle kimyasal bir değişiklikle karakterize edilir ve genellikle reaktanlardan farklı özelliklere sahip bir veya daha fazla ürünle sonuçlanır. İşte bir kimyasal reaksiyon örneği:
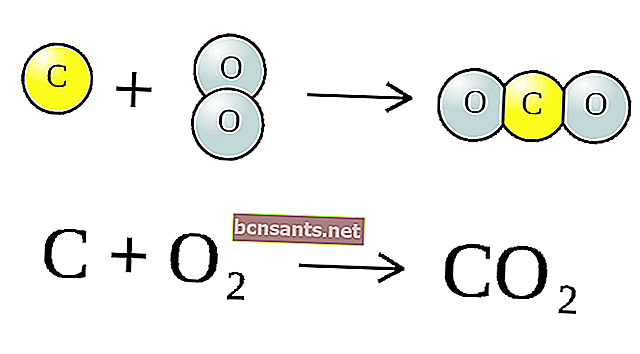
Yukarıdaki kimyasal reaksiyon, 2 karbon monoksit (CO) atomu üretmek için bir karbon atomu (C) ve iki oksijen atomu (O) artı bir karbon (C) içeren bir molekül (CO2) şeklindedir.
Bu sembollerin birleşimine Kimyasal Denklem adı verilir . Okun solundaki maddelere reaksiyon başına (CO2) ve C, oktan sonra ise reaksiyon ürünleri, yani CO adı verilir.
Kimyasal Reaksiyonun Özellikleri
Gerçek dünyadaki kimyasal reaksiyonları, örneğin kağıt yakarken bulmak çok kolaydır. İlk kağıt hala beyaz bir sayfadır, ateş kullanarak yaktıktan sonra renkli kağıt yanar.

Ayrıca suyu kaynattığımızda. Sıradaki sıvı su, ocak üzerine konulan bir tencerede kaynatıldıktan sonra gaz ve su buharı haline gelir.
Bu olaylar gerçek bir kimyasal reaksiyonun işaretleridir. Ancak ürünün oluşumu için sonucu görmek oldukça zordur. Kimyasal bir reaksiyonun özellikleri şunlardır:
1 . Solma
Kimyasal moleküller / bileşikler, maddelere bağlı olarak renkleri emme ve renk yayma özelliğine sahiptir. Bu yetenek ayrıca bir olaydan da etkilenebilir.
Örneğin: Açık alanda çok uzun süre ve ıslak halde bırakılan demir reaktanlar paslanacaktır (kahverengimsi sarı).
2. Sıcaklık Değişimi
Kimyasal moleküller / bileşikler, kimyasal bağlar şeklinde iç enerjiye sahiptir. Bu bağlar enerji gerektirir veya enerji açığa çıkarabilir.
Birçok bağ oluştuğunda, sıcaklık arttıkça enerji açığa çıkar. Örneğin: Ocakta LPG gazı yakmak
3. Gaz kabarcıklarının görünümü
Kimyasal reaksiyonlarda gazlar ısınma nedeniyle oluşabilir.
Örneğin: Isıtıldığında hamurdaki kabartma tozu molekülleri / bileşikleri, kekin genişlemesi için gaz salar.
4. Hacim Değişimi
Kimyasal bir reaksiyondan kaynaklanan ürünler oluştuğunda, bu, reaktanların hacminin azaldığı anlamına gelir. Örneğin: Yaz aylarında göl suyu hacmi azalır.
5. Oluşan Tortu
Çökelti, katı hale gelen iki çözelti arasında kalan bir kimyasal reaksiyondur. Bu madde, çözelti çok doymuş olduğu için oluşabilir.
Örneğin: Gümüş nitrat solüsyonu (AgNO3) potasyum klorür (KCl) içeren bir solüsyona eklenir, beyaz bir gümüş klorür (AgCl) çökeltisi oluşur.
6. Işık Yayan
Kimyasal reaksiyonlar bazen ışık şeklinde enerji açığa çıkarır
Örneğin: Güneşe tepki
7. İletkenlikteki Değişiklikler
Kimyasal reaksiyonlar iletkenlikteki değişiklikleri etkiler (ısı iletme yeteneği).
8. Tat değişikliği
Pirinç çiğnerken meydana gelen kimyasal reaksiyon, dile dokunduğunda tatlı bir tat yaratır.
Etki eden faktörler

Bir kimyasal reaksiyondaki reaksiyon hızı veya hızı, birim zamanda meydana gelen kimyasal reaksiyonların sayısını belirtir.
Bu hız, reaksiyon sürecini hızlandıran veya yavaşlatan çeşitli faktörlerden etkilenir. İşte faktörler.
1. Reaktanların Ölçümü
Hala yığın halinde olan kaba tuz veya tuz. Bu kaba tuz, büyüklüğü nedeniyle suda oldukça yavaş çözünür. Böylece kimyasal reaksiyon, maddenin boyutuna çok bağlıdır.
Ayrıca şunu okuyun: Talep ve Arz - Tanım, Yasalar ve Örnekler2. Sıcaklık
Sıcaklık, kimyasal reaksiyonları, yani ısıtma yoluyla etkileyebilir. Örneğin, yaz aylarında, kereste ormanları yağışlı mevsime göre daha hızlı yanar.
3. Katalizör
Katalizör, belirli bir sıcaklıkta kimyasal reaksiyonların hızını, herhangi bir değişiklik yaşamadan veya reaksiyonun kendisi tarafından kullanılmadan hızlandıran bir maddedir. Enzimler bir tür katalizördür. Enzimler olmadan bu reaksiyon, metabolizmanın gerçekleşmesi için çok yavaş olacaktır.
Örneğin, Maltaz Enzimi, maltozu (bir tür polisakkarit veya kompleks şeker) glikoza dönüştürür.Aşağıda, C'nin katalizörü temsil ettiği genel bir katalitik reaksiyon şeması verilmiştir:
A + C → AC (1)
B + AC → AB + C (2)
Kimyasal Reaksiyon Aşamaları
Reaksiyon aşamaları kolayca şu şekilde ayrılabilir:
- Bağların feshi,
- Geçiş bileşiklerinin oluşumu
- Bağ Oluşumu
İki moleküllü bileşikler için aşamalar, temel reaksiyon nedeniyle daha karmaşıktır.
- Reaksiyon başlatma aşaması
- Bağların feshi
- Geçiş bileşiklerinin oluşumu
- Ürün oluşumu
- Enerji stabilizasyonu (enerjiyi / genellikle ısıyı emerek veya salarak)
Çeşitli
Kimyasal reaksiyonlar çok çeşitlidir, ancak birkaç reaksiyon türü olarak sınıflandırılabilir:
1. Birleşme Reaksiyonu
Yeni bir madde oluşturmak için birleşen iki maddenin reaksiyonu. NaCl tuzunun oluşumunun kolay bir örneği: 2Na + Cl2 → 2NaCl
2. Reaksiyon Ayrışımı
Kimyasal bir reaksiyonda oluşan bir bileşik ikiden fazla maddeye ayrılır. Bir örnek su H2O: 2H2O → 2H2 + O2'nin ayrışmasıdır.
3. Tek Değişim Reaksiyonu
Bir değişim reaksiyonu, bir elementin bir bileşikle reaksiyona girerek o bileşikte bulunan elementleri değiştirdiği reaksiyondur. Örneğin, bakır bir gümüş nitrat çözeltisine daldırılırsa, gümüş metal kristalleri üretilir. Reaksiyonun denklemi:
Cu (k) + 2AgNO 3 (aq) → 2Ag (k) + Cu (NO 3 ) 2 (sulu)
4. Çoklu değişim reaksiyonları
Genellikle metatez reaksiyonu olarak adlandırılan bu reaksiyon, reaktanların kısmen değişim reaksiyonudur. Reaktif bir laurtan iyonik bileşik ise, değiştirilen kısımlar bileşiğin katyonları ve anyonlarıdır. Örneğin, asitlerin aşağıdaki gibi bazlarla reaksiyonu:
HCI (aq) + NaCI (aq) + H → NaOH (sulu) 2 O (I)
5. Yanma Reaksiyonu
Bu reaksiyon, atomları yeniden düzenlemek için bir reaksiyon olarak bilinir. Reaktiflerden biri oksijendir.
Yani, yanma reaksiyonu, bir maddenin oksijenle kimyasal reaksiyonudur ve genellikle bir alev görünene kadar ısının salınmasıyla daha hızlı reaksiyona girer. Örneğin metan yakmak
CH 4 (g) + 2O 2 (g) CO → 2 (g) + 2H 2 O (g)
Kimyasal Reaksiyon Örnekleri
Gerçek hayatta bulunabilecek pek çok tepki var. Bazıları laboratuvarda pratik olarak kasıtlıdır, böylece doğal olarak gerçekleşir.
Bu kimyasal reaksiyonlardan bazıları, yeni ürünlere katılma reaksiyonları, yanma, ayrışma ve diğerlerini içerebilir. İşte bazı yaygın tepkiler:
1. Sabun Oluşumu

Fidan reaksiyonu, gliserol ve yağ asidi tuzları veya sabun üretmek için NaOH veya KOH gibi güçlü bir baz kullanan bir katı yağ / sıvı yağ hidroliz reaksiyonudur. NaOH sert sabun üretiminde kullanılırken, KOH yumuşak sabun veya sıvı sabun üretiminde kullanılır.
Sert sabunun suda çözünürlüğünden bakıldığında, sert sabunun yumuşak sabuna göre suda daha az çözünür olmasıdır. Sabunlaşma reaksiyonuna ayrıca sabunlaşma reaksiyonu da denir.

2. Tuza Asit-Baz Reaksiyonu
Ayrıca şunu okuyun: Coğrafyanın 4 İlkesi ve Hayatımızda UygulanmasıKimyada tuz, pozitif iyonlar (katyonlar) ve negatif iyonlardan (anyonlar) oluşan iyonik bir bileşiktir ve nötr bir bileşik oluşturur (yüklenmeden). Tuz, asitlerin ve bazların reaksiyonundan oluşur. Tuz ayrıca iki farklı tuzdan da oluşturulabilir, örneğin:
Pb (NO 3 ) 2 (aq) + Na 2 SO 4 (aq) → PbSO 4 (k) + 2 NaNO 3 (aq)
3. Korozyon Reaksiyonu
Korozyon, bir metal ile çevresinde bulunan ve istenmeyen bileşikler üreten çeşitli maddeler arasındaki redoks reaksiyonları nedeniyle metallerin yok edilmesidir.
Korozyon sürecinde, demir (Fe) bir indirgeyici madde, suda çözünen oksijen (O2) ise bir oksitleyici görevi görür. Pas oluşumu için reaksiyon denklemi aşağıdaki gibidir:
Fe ( k ) → Fe2 + ( aq ) + 2e–
O 2 ( g ) + 4H + ( aq) + 4e– → 2H 2 O ( l )
4. Fotosentez reaksiyonları
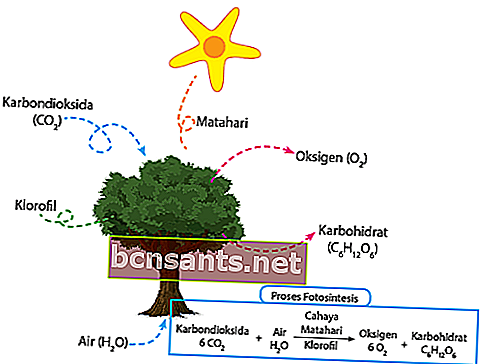
KBBI'ye göre fotosentez süreci, su ve karbondioksiti karbonhidratlara dönüştürmek için güneş ışığını kullanan yeşil bir bitkidir. Bitkinin etrafındaki karbondioksit, yapraklardaki stoma dokusu tarafından doğrudan emilir. Bitki çevresinde bulunan su direkt olarak kökler vasıtasıyla emilir ve bitki sapları vasıtasıyla yapraklara iletilir.
Tam öğle vakti, düşen ışık yoğunluğu, fotosentez için klorofil tarafından doğrudan yakalanır. Güneş ışığından daha önce yakalanan enerji, suyu doğrudan oksijene ve hidrojene dönüştürecektir.
Son olarak, üretilen hidrojen, bu bitkilerin ihtiyaçları için gıda üretmek üzere doğrudan karbondioksit ile birleştirilecektir. Geri kalanı, oksijen stomalar yoluyla doğrudan havaya salınır. İşte kimyasal denklem:
6CO2 + 6H2O + ışık = C6H12O6 + 6O2
5. Sirke ve Kabartma Tozunun Kimyasal Reaksiyonları
Sirke ve kabartma tozu, okulunuzda oyuncak bir volkan püskürmesi yapıp yapamayacağı konusunda kimyasal reaksiyon hakkında hiç bilgi aldınız mı?
Alkali bileşiklerle karıştırılan asidik bileşikler, nötr bileşikler üretecektir. Deneyde, zayıf bir asit bileşiği bir asetik asit (CH3COOH) çözeltisi ile bir kabartma tozu (NaHCO3) çözeltisi içinde güçlü bir baz bileşiği içinde karıştırıldı.

Kimyasal bir reaksiyonda, bir veya daha fazla madde yeni maddelere dönüştürülebilir, deneye göre asit sirkesi (CH3COOH) karbonat (NaHCO3) ile reaksiyona sokularak CO2 gazı üretilir.
Asit sirke (CH3COOH) ve kabartma tozu (NaHCO3) reaksiyona girerse, karbondioksit gazı (CO2) oluşumuna neden olan kabarcıklar üretecektir. Bu gazlar ve sıvılar lav gibi sıvıların dışarı çıkmasına neden olur.
6. Enzimatik kimyasal reaksiyonlar
Enzimler , organik bir kimyasal reaksiyonda katalizör (reaksiyon sürecini tamamen reaksiyona girmeden hızlandıran bileşikler) olarak işlev gören protein formundaki biyomoleküllerdir.
Katalizör bileşiği ilk reaksiyonda değişebilmesine rağmen, son reaksiyonda katalizör molekülleri orijinal şekillerine geri dönecektir. Enzimler, daha düşük aktivasyon enerjisi gerektiren bir organik reaksiyon yoluyla ara bileşikler üretmek için substrat molekülleri ile reaksiyona girerek çalışır, böylece kimyasal reaksiyonlar hızlanır, çünkü daha yüksek aktivasyon enerjili kimyasal reaksiyonlar daha uzun sürer.
Örneğin: Katalaz enzimi, hidrojen peroksitin suya ve oksijene parçalandığı bir reaksiyonu katalize eden bir enzimdir.
