
Elementlerin periyodik sistemi, kimyasal elementleri temsil eden bir düzenlemedir. Genellikle periyodik eleman sistemi tablo şeklinde düzenlenmiştir.
Elementlerin periyodik sisteminin düzenlenmesi atom numaralarına, elektron konfigürasyonlarına ve kimyasal özelliklere dayanmaktadır.
Aşağıdaki, periyodik eleman sisteminin düzenidir:
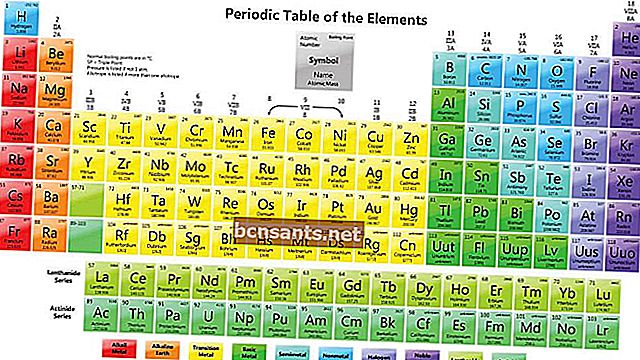
Elementlerin periyodik sistemindeki elementler nasıl okunur
SPU'da, her bir öğenin yazısını aşağıda gösterildiği gibi bulacaksınız.
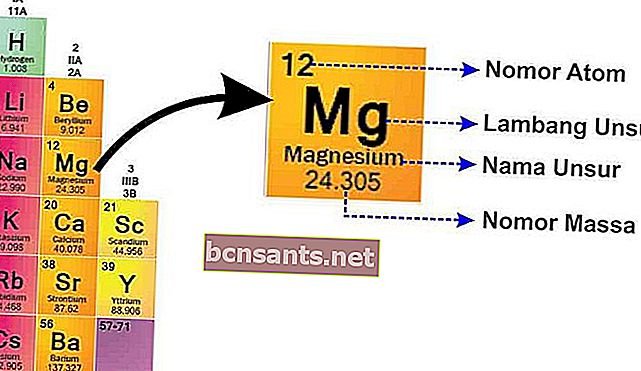
Bu resimden açıklayabilir:
- Kütle Numarası
Kütle numarası, pozitif yüklü protonlar olduğu için pozitif yüklü atomun çekirdeğidir.ve nötr olan nötronlar
- Atomik numara
Atom numarası size proton sayısını söyler, çünkü atom nötr olduğu için atom numarası size elektron sayısını da söyler .
Eleman Gruplama
Periyodik eleman sisteminde, her eleman buna göre gruplandırılır.
- Grup
Gruplar, element periyodik sistem tablosunun dikey sütunundadır. Aynı gruptaki elementler aynı değerlik elektron konfigürasyonuna sahip olacaktır.

- Periyot
Periyotlar, periyodik sistem element tablosu üzerinde yatay sırada yer alan elementlerdir. Periyot iyonlaşma enerjisini , atom yarıçapını, elektron ilgisini ve elektronegatifliği gösterir.

- Blok
Bir blok, aynı değerlik elektronları alt kabuğuna sahip bir elementler koleksiyonunu temsil eder.

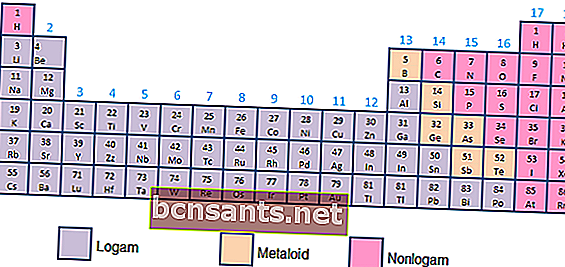
- Metaller, metaloidler ve metal olmayanlar
Kimyasal ve fiziksel özelliklere bağlı olarak elementler, metaller (yüksek iletkenlik), metaloidler (metaller ve metal olmayanlar arasında iletkenlik) veya metal olmayanlar (gazlar şeklinde iletkenlik özelliklerine sahip olmayan) olarak kategorize edilebilir.
İyonlaşma enerjisi, atom yarıçapı, elektron ilgisi ve elektronegatiflik
İyonlaşma enerjisi, atom yarıçapı, elektron ilgisi ve elektronegatiflik, elemental sistemdeki elementlerin periyotlarına ve gruplarına bağlı olarak görülebilir.
Ayrıca şunu okuyun: Uçak kazası kurbanlarının cesetlerini nasıl tespit edersiniz?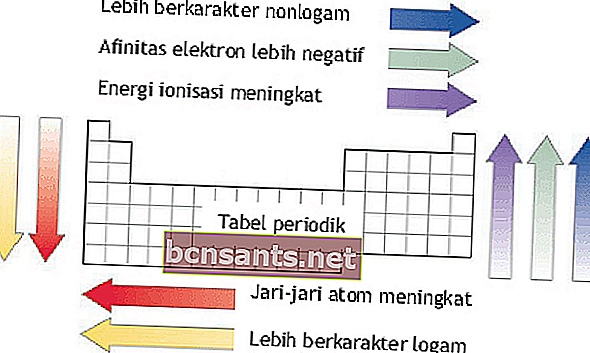
İyonlaşma enerjisi
İyonlaşma enerjisi, dış elektronlardan birini gaz halindeki bir atomdan çıkarmak için gereken enerjidir.
Bir dönemde atom numarası arttıkça iyonlaşma enerjisi soldan sağa doğru artar.
Bir grup içinde, atom numarası arttıkça iyonlaşma enerjileri yukarıdan aşağıya doğru azalır.
Atom yarıçapı
Atom yarıçapı, atom çekirdeğinin atomun en dıştaki yörüngesine olan mesafesidir.
Bir dönemde atom yarıçapı yukarıdan aşağıya doğru artar.
Bir grup içinde, atom yarıçapı sağdan sola doğru artar.
Elektron ilgisi
Elektron ilgisi, bir atomun gaz halindeki negatif iyonları oluşturmak için saldığı enerjidir.
Bir dönemde elektron ilgisi aşağıdan yukarıya doğru artar. Bir grup içinde, elektron ilgisi soldan sağa doğru artar.
Elektronegatiflik
Elektronegatiflik, bir atomun kimyasal bağların oluşumunda elektronları çekme eğiliminin değeridir. Bu özellik, atomlar arasındaki bağların oluşumunda önemlidir.
Bir dönemde elektronegatiflik aşağıdan yukarıya doğru artar.
Bir dönemde elektronegatiflik soldan sağa doğru artar.
Referans
- Elementlerin periyodik tablosu
- //www.studiobelajar.com/sistem-periodic-elements/
